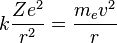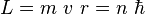Un modelo atómico es una representación estructural de un átomo, que trata de explicar su comportamiento y propiedades. A lo largo del tiempo existieron varios modelos atómicos y algunos fueron más elaborados que otros. El modelo atómico que está vigente es el Modelo Mecánico Cuántico y es el resultado de la investigación de varios científicos en conjunto.
En esta web encontraras un resúmen cronológico de las teorías postuladas por diversos científicos, entorno a la existencia del átomo. En su momento cada uno de estos científicos, planteó su propia "Teoría Atómica". Dichas teorías han ido evolucionando, hasta nuestros días, en base a nuevos descubrimientos sobre la materia y su naturaleza.
domingo, 15 de mayo de 2011
Los Metales
A continuación haz clic sobre la imágen, para ver un mapa conceptual sobre los metales, sus principales características y propiedades.
Cronología sobre las Teorías Atómicas
A continuación te presento un cuento interactivo sobre la evolución de las teorías atómicas.
El Átomo
Átomo (del latín atomum, y éste del griego ἄτομον, sin partes; también, se deriva de "a" no, y "tomo" divisible; no divisible), es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades, y que no es posible dividir mediante procesos químicos.
Su denso núcleo representan el 99.9% de la masa del átomo, y está compuesto de nucleones llamados protones y neutrones, rodeados por una nube de electrones, que -en un átomo neutro- igualan el número de protones.
El concepto de átomo como bloque básico e indivisible que compone la materia del universo fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.
Estructura atómica
A pesar de que "átomo" significa "indivisible", hoy día se sabe que el átomo está formado por partículas más pequeñas, las llamadas partículas subatómicas.
El núcleo del átomo es su parte central. Tiene carga positiva, y en él se concentra casi toda la masa del mismo. Sin embargo, ocupa una fracción muy pequeña del volumen del átomo: su radio es unas diez mil veces más pequeño. El núcleo está formado por protones y neutrones.
Alrededor del núcleo se encuentran los electrones, partículas de carga negativa y masa muy pequeña comparada con la de los protones y neutrones: un 0,05% aproximadamente. Los electrones se encuentran alrededor del núcleo, ligados por la fuerza electromagnética que éste ejerce sobre ellos, y ocupando la mayor parte del tamaño del átomo, en la llamada nube de electrones.
El núcleo atómico
El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos clases:
- Protones: una partícula con carga eléctrica positiva igual a una carga elemental, y una masa de 1,67262 × 10–27 kg.
- Neutrones: partículas carentes de carga eléctrica, y con una masa un poco mayor que la del protón (1,67493 × 10–27 kg).
La cantidad total de nucleones que contiene un átomo se conoce como número másico, representado por la letra A y escrito en la parte superior izquierda del símbolo químico. Para los ejemplos dados anteriormente, el número másico del hidrógeno es 1 (1H), y el del helio, 4 (4He).
El Atomismo
El atomismo, uno de los principios de la química como ciencia, es un sistema filosófico, que surgió en Grecia durante el siglo V a. C. y en la India, hacia el año 200 a. C.- 100 a. C. (Kanada), aunque tal vez mucho antes (Mosco de Sidón), según el cual el universo está constituido por combinaciones de pequeñas partículas indivisibles denominadas átomos (en griego significa que no se puede dividir).
En las antiguas vidas, el átomo se definía como el elemento más grande, a la vez extenso e indivisible, del que están hechas todas las cosas. Según el atomismo mecanicista de Leucipo y Demócrito (siglos V y IV a. C.), los átomos son unas partículas materiales indestructibles, desprovistas de cualidades, que no se distinguen entre sí más que por la forma y dimensión, y que por sus diversas combinaciones en el vacío constituyen los diferentes cuerpos. La concepción de la naturaleza fue absolutamente materialista, y explicó todos los fenómenos naturales en términos de número, forma y tamaño de los átomos. Incluso redujo las propiedades sensoriales de las cosas a las diferencias cuantitativas de los átomos.
Democrito de Abdera
Aristóteles rechaza la idea atomística con el argumento de que no puede existir el vacío subyacente entre las partículas. Según la doctrina aristotélica, la materia está constituida de forma continua, es decir, que no puede dividirse en partes irreductibles.
Para evitar el determinismo mecanicista, criticado por Aristóteles, Lucrecio toma el pensamiento de Epicuro e introduce la tesis de que los átomos caen en el vacío y experimentan por sí mismos una declinación que les permite encontrarse. De esta forma se trata de imponer un cierto orden a la idea original que suponía que las cosas se formaban con un movimiento caótico de átomos.
El atomismo aparece en la filosofía griega como un intento de superar las dificultades lógicas para explicar el cambio de las cosas consideradas en la Escuela eleática. Afirma lo que ésta misma afirma y puede afirmar también lo que esta niega, haciéndose así más comprensiva como teoría. No hay disyuntiva entre ser y no ser, sino ambas cosas, sólo que el ser no es efectivamente tal, esto es, espacio y vacío. Esta simultaneidad de los contrarios constituye la fuente del movimiento. Esta teoría atómica recorre con tal fluidez el tránsito del ser a las cosas, suprime de golpe tantos obstáculos para la comprensión mecánica y matemática del universo, que desde entonces se convirtió en modelo para cualquier investigación racional de la naturaleza. También se presenta como afín al pluralismo de Anaxágoras o de Empédocles (siglo V a. C.), Anaxágoras consideraba que todo estaba hecho de partículas elementales llamadas Homeomerías conceptualmente diferentes (aunque muy similares) a los átomos de Leucipo y Demócrito, mientras que Empédocles afirmaba que casi todas las cosas (no los ojos, por ejemplo) están compuestas por de los cuatro elementos, a saber: aire, agua, tierra y fuego.
Anaxágoras
En la edad media, a pesar de la oposición general al atomismo basada en consideraciones teológicas, y sobre todo por la fuerte influencia de Aristóteles, esta doctrina fue mantenida por Guillermo de Conches y Nicolás de Autrecourt. La teoría cobra nuevo auge en los siglos XV y XVI, coincidiendo con la crítica al aristotelismo, con las ideas de Nicolás de Cusa y Giordano Bruno, alcanzando un punto culminante con la renovación de Gassendi, que considera el atomismo como la hipótesis más razonable para la explicación de los fenómenos de la naturaleza. En esta época fueron debatidos los problemas inherentes a la doctrina atomista: dificultad lógica de admitir que exista una porción de materia que no se pueda dividir y las dificultades de explicar la diversidad de las propiedades físicas y químicas de los cuerpos. Asimismo es innegable la influencia que adquirió más tarde en los orígenes de la teoría atómica científica.
Modelo atómico de John Dalton
El modelo atómico de Dalton, surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton. El siguiente modelo fue el modelo atómico de Daltón.
Éxitos del modelo
 El modelo atómico de Dalton explicaba por qué las sustancias se combinaban químicamente entre sí sólo en ciertas proporciones.
El modelo atómico de Dalton explicaba por qué las sustancias se combinaban químicamente entre sí sólo en ciertas proporciones.- Además el modelo aclaraba que aún existiendo una gran variedad de sustancias, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos.
- En esencia, el modelo explicaba la mayor parte de la química orgánica del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria.
Puntosencontra:
* Este modelo atómico no explicaba la existencia de los isótopos.
* Daltón supuso que el átomo era indivisible; sin embargo hoy en
día sabemos que no es así, pues está formado por varias partículas sub atómicas: Protones, neutrones, electrones; etc.
Postulados de Dalton
Dalton explicó su teoría formulando una serie de enunciados simples.- La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir.
- Los átomos de un mismo elemento son iguales entre sí, tienen su propio peso y cualidades propias. Los átomos de los diferentes elementos tienen pesos diferentes.
- Los átomos permanecen sin división, aún cuando se combinen en las reacciones químicas.
- Los átomos, al combinarse para formar compuestos guardan relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos.
Modelo atómico de Joseph Thomson
El modelo atómico de Thomson, es una teoría sobre la estructura atómica propuesta en 1904 por Joseph John Thomson, descubridor del electrón en 1897, mucho antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrónes de carga negativa en un átomo positivo, como un pudin de pasas.
Se pensaba que los electrones se distribuían uniformemente alrededor del átomo. En otras ocasiones, en lugar de una sopa de carga negativa se postulaba con una nube de carga positiva. En 1906 Thomson recibió el premio Nobel de Física por sus investigaciones en la conducción eléctrica en gases.
El átomo no deja de ser un sistema material que contiene una cierta cantidad de energía externa. Ésta provoca un cierto grado de atracción de los electrones contenidos en la estructura atómica. Desde este punto de vista, puede interpretarse que el modelo atómico de Thomson es un modelo actual como consecuencia de la elasticidad de los electrones en el coseno de la citada estructura.
Si hacemos una interpretación del modelo atómico desde un punto de vista más microscópico, puede definirse una estructura abierta para el mismo, dado que los protones se encuentran inmersos y sumergidos en el seno de la masa que define la carga neutra del átomo.
Dicho modelo fue rebatido tras el experimento de Rutherford, cuando se descubrió el núcleo del átomo. El modelo siguiente fue el modelo atómico de Rutherford.
Modelo atómico de Ernest Rutherford
El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford para explicar los resultados de su "experimento de la lámina de oro", realizado en 1911.
El modelo de Rutherford fue el primer modelo atómico que incorporó el hecho de que el átomo estaba formado por dos partes: La corteza, que está constituida por todos los electrones que hay en el átomo, girando a gran distancia alrededor del núcleo, y el núcleo:(es muy pequeño; en él se encuentra toda la carga eléctrica positiva y casi toda la masa del átomo). Este modelo suponía que el átomo, estaba formado por tres partículas: protones y neutrones, estos se encuentran en el núcleo; y electrones (está en la corteza). Aunque hoy se sabe que los protones y los neutrones son partículas compuestas y que las interacciones entre ellos requieren partículas transmisoras de las fuerzas nucleares.
Importancia del modelo y limitaciones
La importancia del modelo de Rutherford residió en proponer por primera vez la existencia de un núcleo en el átomo. Término que, paradójicamente, no aparece en sus escritos. Lo que Rutherford consideró esencial, para explicar los resultados experimentales, fue "una concentración de carga" en el centro del átomo, ya que sin ella, no podía explicarse que algunas partículas fueran rebotadas en dirección casi opuesta a la incidente. Este fue un paso crucial en la comprensión de la materia, ya implicaba la existencia de un núcleo atómico donde se concentraba toda la carga positiva y más del 99,9% de la nasa. Las estimaciones del núcleo revelaban que el átomo en su mayor parte estaba vacío.
Rutherford propuso que los electrones orbitarían en ese espacio vacío alrededor de un minúsculo núcleo atómico, situado en el centro del átomo. Además se abrían varios problemas nuevos que llevarían al descubrimiento de nuevos hechos y teorías al tratar de explicarlos:
- Por un lado se planteó el problema de cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan pequeño, hecho que llevó posteriormente a la postulación y descubrimiento de la fuerza nuclear fuerte, que es una de las cuatro interacciones fundamentales.
- Por otro lado existía otra dificultad proveniente de la electrodinámica clásica que predice que una partícula cargada y acelerada, como sería el caso de los electrones orbitando alrededor del núcleo, produciría radiación electromagnética, perdiendo energía cayendo sobre el núcleo. Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10 − 10s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo. Se trata, por tanto de un modelo físicamente inestable, desde el punto de vista de la física clásica.
Según Rutherford, las órbitas de los electrones no están muy bien definidas y forman una estructura compleja alrededor del núcleo, dándole un tamaño y forma algo indefinidas. No obstante, los resultados de su espxperimento, permitieron calcular que el radio del átomo era diez mil veces mayor que el núcleo mismo, lo que hace que haya un gran espacio vacío en el interior de los átomos.
Modelo atómico de Niels Bohr
El modelo atómico de Bohr o de Bohr-Rutherford es un modelo clásico del átomo, pero fue el primer modelo atómico en el que se introduce una cuantización a partir de ciertos postulados (ver abajo). Fue propuesto en 1913 por el físico danés Niels Bohr, para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos (dos problemas que eran ignorados en el modelo previo de Rutherford). Además el modelo de Bohr incorporaba ideas tomadas del efecto fotoeléctrico, explicado por Albert Einstein en 1905.
Postulados de Bohr
En1913, Niels Bohr desarrolló su célebre modelo atómico de acuerdo a tres postulados fundamentales.
Primer postulado
Los electrones describen órbitas circulares en torno al núcleo del átomo sin radiar energía.
La causa de que el electrón no radie energía en su órbita es, de momento, un postulado, ya que según la electrodinámica clásica un carga en movimiento acelerado debe emitir energía en forma de radiación.
Para conseguir el equilibrio en la órbita circular, las dos fuerzas que siente el electrón: la fuerza coulombiana, atractiva, por la presencia del núcleo y la fuerza centrífuga, repulsiva por tratarse de un sistema no inercual, deben ser iguales en módulo en toda la órbita. Esto nos da la siguiente expresión:
- Donde el primer término es la fuerza eléctrica o de Coulomb, y el segundo es la fuerza centrífuga; k es la constante de la fuerza de Coulomb, Z es el número atómico del átomo, e es la carga del electrón, me es la masa del electrón, v es la velocidad del electrón en la órbita y r el radio de la órbita.
Segundo postulado
No todas las órbitas para electrón están permitidas, tan solo se puede encontrar en órbitas cuyo radio cumpla que el momento angular, L, del electrón sea un múltiplo entero de h' = h / 2 π
. Esta condición matemáticamente se escribe:
- con n = 1, 2, 3, ...
A partir de ésta condición y de la expresión para el radio obtenida antes, podemos eliminar v y queda la condición de cuantización para los radios permitidos:
- con n = 1, 2, 3, ...
- subíndice introducido en esta expresión para resaltar que el radio ahora es una magnitud discreta, a diferencia de lo que decía el primer postulado.
Ahora, dándole valores a n, número cuántico principal, obtenemos los radios de las órbitas permitidas. Al primero de ellos (con n=1), se le llama radio de Bohr.:
- expresando el resultado en angstrom.
Tercer postulado
El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles. Este fotón, según la ley de Planck tiene una energía:
- donde ni identifica la órbita inicial y nf la final, y ν es la frecuencia.
Modelo atómico de Arnold Sommerfeld
El modelo atómico de Sommerfeld es un modelo atómico hecho por el físico alemán Arnold Sommerfeld (1868-1951) que básicamente es una generalización relativista del modelo atómico de Bohr (1913).
Insuficiencias del modelo de Bohr
El modelo atómico de Bohr funcionaba muy bien para el átomo de hidrógeno, sin embargo, en los espectros realizados para átomos de otros elementos se observaba que electrónes de un mismo nivel energético tenían distinta energía, mostrando que algo andaba mal en el modelo. Su conclusión fue que dentro de un mismo nivel energético existían subniveles, es decir, energías ligeramente diferentes para un nivel energético dado.
Además desde el punto de vista teórico, Sommerfeld había encontrado que en ciertos átomos las velocidades de los electrones alcanzaban una fracción apreciable de la velocidad de la luz. Sommerfeld estudió la cuestión para electrones relativistas.
En 1916, Arnold Sommerfeld, con la ayuda de la relatividad de Albert Einstein, hizo las siguientes modificaciones al modelo de Bohr:
- Los electrones se mueven alrededor del núcleo en órbitas circulares o elípticas.
- A partir del segundo nivel energético existen dos o más subniveles en el mismo nivel.
- El electrón es una corriente eléctrica minúscula.
En consecuencia el modelo atómico de Sommerfeld es una generalización del modelo atómico de Bohr desde el punto de vista relativista, aunque no pudo demostrar las formas de emisión de las órbitas elípticas, solo descartó su forma circular.
Suscribirse a:
Entradas (Atom)